Nelle scorse settimane ad infiammare vivaci dibattiti è stata la notizia del prossimo rilascio di un nuovo farmaco contro la cecità, il Luxturna. Tuttavia a sconvolgere di più il pubblico non è stato il suo successo clinico, bensì il costo della terapia: 425,000$ per occhio (850,000$ in totale). Il nuovo farmaco prodotto dalla Spark Therapeutics quindi rappresenta uno dei farmaci più costosi mai messo in commercio nella storia degli Stati Uniti.
Un altro farmaco un po’ di tempo prima aveva creato indignazione per il prezzo esorbitante, cioè il Kymriah, nuova terapia anti-cancro prodotta dalla Novartis per un costo di 475,000 franchi svizzeri (poco più di 400,000 €) per dose.
Molte testate giornalistiche hanno gridato allo scandalo sostenendo che questi “farmaci per ricchi” sarebbero stati proibitivi per la maggior parte dei sistemi sanitari nazionali, e che il comportamento della case farmaceutiche fosse anti-etico poiché il margine di guadagno sarebbe troppo alto.
Non è nell’intento di questo articolo entrare nel merito dei complessi meccanismi economici che hanno determinato prezzi così alti, quanto piuttosto spiegare l’innovativo significato scientifico che questi farmaci posseggono, poiché rappresentano una stimolante finestra verso l’innovazione biotecnologica in medicina.
Indice dell'articolo
Terapia genica: come funziona?
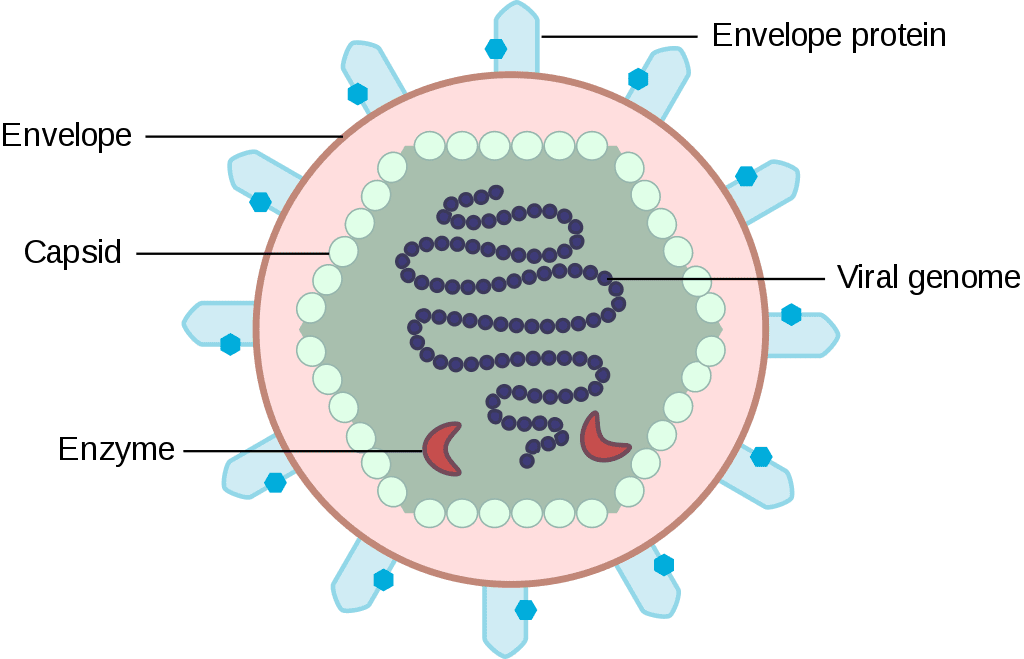
Per terapia genica si intende l’atto di inserire geni artificiali nelle cellule umane attraverso dei particolari vettori. Il gene (unità fondamentale dell’informazione genetica) è un frammento di DNA che esprime un’informazione sotto forma di proteina, cioè semplicisticamente ad ogni gene corrisponde una proteina. Molte malattie ereditarie sono causate dalla mutazione di un solo gene e quindi dall’alterazione di una sola proteina. Il principio quindi è sostituire il gene malato con una versione sana e funzionante, ma come trasferirlo nella cellula?
Si sono sfruttate le straordinarie proprietà dei virus, microrganismi in grado di inserire i propri geni nelle cellule umane così da costringerle a produrre proteine virali utili per la riproduzione del microbo. I virus sfruttati per la terapia genica sono privati dei propri geni virulenti dannosi mentre vi si impianta il gene utile che si vuole inserire nel paziente, in modo da fornirgli la proteina che gli mancava. I virus sfruttati per questi processi possono essere adenovirus (virus a DNA responsabili di infezioni respiratorie o intestinali) o retrovirus a RNA simili all’HIV. È eventualmente possibile usare anche vettori non-virali o microsomi, cioè sfere di lipidi capaci di fondersi con la membrana cellulare e rilasciare il gene nella cellula, sebbene abbiano un’efficienza molto inferiore rispetto ai virus.
Luxturna, virus contro la cecità
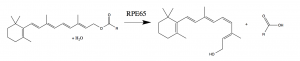
Luxturna è il nome commerciale di voretigene neparvovec, virus sperimentato per il trattamento di un raro tipo di cecità ereditaria chiamata amaurosi congenita di Leber. Questa patologia consiste in un grave deficit visivo presente dalla nascita e causato dalla mutazione di geni essenziali per la vista. Alcune varianti della malattia sono provocate dal malfunzionamento del gene RPE65. Questo gene codifica per una proteina enzimatica fondamentale per la formazione del pigmento visivo nella retina, grazie al quale è possibile percepire gli stimoli luminosi.
Iniettando il luxturna nel corpo vitreo del paziente si inserisce il gene mancante permettendo la produzione del pigmento e il graduale recupero parziale della vista. Si sostiene che per ottenere risultati soddisfacenti a lungo termine basti una sola somministrazione del farmaco nella vita.
Kymriah: terapia genica contro i tumori
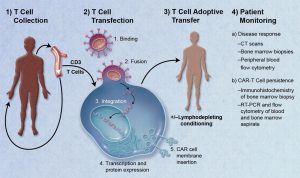
Definire il Kymriah un “farmaco” è decisamente riduttivo. Infatti anziché un preparato da assumere è piuttosto un processo biotecnologico attraverso cui si prelevano dei globuli bianchi (dal paziente stesso o da un donatore) e li si modifica in laboratorio attraverso terapia genica in modo da fargli esprimere un recettore modificato. Il processo chiamato tisagenleucel produce dunque le cosiddette CAR T-cell (linfociti T con recettore chimerico artificiale), cioè linfociti geneticamente modificati per riconoscere e distruggere le cellule tumorali una volta re-infusi nel paziente. Il recettore chimerico riconosce la proteina CD19 presente sui linfociti B maligni, e questo può essere sfruttato per combattere tumori aggressivi come la leucemia linfoblastica acuta e i linfomi diffusi a grandi cellule B.
Data la complessità di questo processo terapeutico è ben comprensibile perché il kymriah figuri tra i farmaci più costosi di sempre. Inoltre si stima che oltre al prezzo dichiarato del farmaco si aggiungano spese collaterali. Senza contare che per queste patologie tumorali non basta una sola somministrazione.
Conclusioni
La terapia genica rappresenta una frontiera interessante e promettente verso cui il progresso medico è direzionato: infatti si spera possa essere la soluzione a malattie genetiche verso le quali non si è ancora trovato una cura soddisfacente (ad esempio la fibrosi cistica, l’anemia falciforme, la distrofia muscolare e tante altre). Tuttavia esistono ancora limiti enormi. Infatti il motivo per cui questi sono i farmaci più costosi è che la manipolazione di cellule, virus, DNA o proteine è decisamente complessa. L’evoluzione della farmacologia è passata attraverso l’estrazione di farmaci da vegetali o muffe, poi alla sintesi chimica di molecole semplici, fino alla produzione di biomolecole attraverso le colture batteriche e l’ingegneria genetica. Con l’automatizzazione dei sistemi di produzione e l’affinamento delle tecnologie anche queste terapie quasi fantascientifiche potranno essere disponibili a prezzi inferiori in un prossimo futuro.
Antonio Spiezia
Sitografia:
http://edition.cnn.com/2017/12/20/health/fda-gene-therapy-blindness-bn/index.html
https://www.hcp.novartis.com/products/kymriah/acute-lymphoblastic-leukemia-children/
ATTENZIONE: Le informazioni contenute in questo sito hanno puramente scopo informativo e divulgativo. Questi articoli non sono sufficienti a porre diagnosi e decisioni di trattamento e non sostituiscono mai il parere del medico. Per ulteriori informazioni contattare il proprio medico generico o specialista.